Altri articoli della stanza Idrogeno
L'Utilizzo dell'Idrogeno
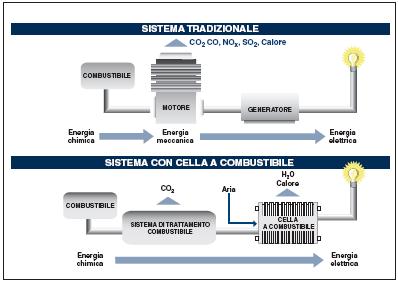
Le due principali utilizzazioni previste in futuro per l’idrogeno e per cui si sta lavorando attualmente nei laboratori di ricerca applicata riguardano l’impiego come combustibile per la generazione di energia elettrica e per il trasporto. Impianti per la produzione centralizzata di energia elettrica e
motori a combustione interna alimentati a IDROGENO sono già fattibili sulla base delle tecnologie esistenti e anche con emissioni sensibilmente ridotte rispetto a quelle degli impianti convenzionali.
Deve tuttavia essere ulteriormente migliorato il rendimento e abbassati i costi; per questo sono in corso di sperimentazione materiali e soluzioni innovative che dovrebbero arrivare a maturazione nel giro di alcuni anni.
Ma lo strumento principale il cui sviluppo condizionerà pesantemente la reale affermazione dell’idrogeno come vettore energetico pulito è senza dubbio la cella a combustibile.
Diamo qui un cenno sul suo funzionamento e alcune indicazioni sullo sviluppo della tecnologia.
LA CELLA A COMBUSTIBILE
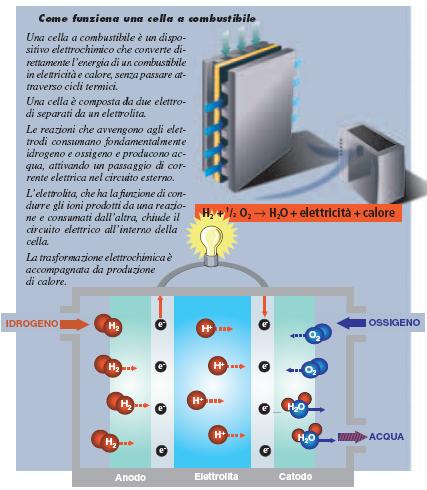
Una cella a combustibile è un dispositivo elettrochimico che converte direttamente l’energia di un combustibile in elettricità e calore senza passare attraverso cicli termici e quindi senza risentire delle limitazioni imposte a questi ultimi dalla termodinamica (figura 1).
In sostanza funziona in modo analogo ad una batteria, in quanto produce energia elettrica attraverso un processo elettrochimico; a differenza di quest’ultima, tuttavia, consuma sostanze provenienti
dall’esterno ed è quindi in grado di funzionare senza interruzioni, finché al sistema viene fornito combustibile ed ossidante.
La cella (v. riquadro sopra) è composta da due elettrodi in materiale poroso, separati da un elettrolita.
Gli elettrodi fungono da siti catalitici per le reazioni di cella che consumano fondamentalmente IDROGENO ed ossigeno, con produzione di acqua e passaggio di CORRENTE elettrica nel circuito esterno. L’elettrolita ha la funzione di condurre gli ioni prodotti da una reazione e consumati dall’altra, chiudendo il circuito elettrico all’interno della cella.
La trasformazione elettrochimica è accompagnata da produzione di calore, che è necessario estrarre per mantenere costante la temperatura di funzionamento della cella.
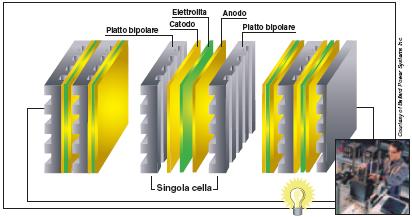
Costruttivamente le celle sono disposte in serie (figura 2), a mezzo di piatti bipolari a formare il cosiddetto “stack”. Gli stack a loro volta sono assemblati in moduli per ottenere generatori della
potenza richiesta.
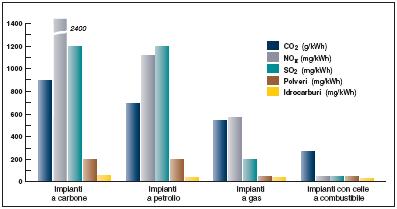
Si ottiene in questo modo un dispositivo ad elevata EFFICIENZA di conversione energetica, di rendimento quasi indipendente dal carico e dalla taglia dell’impianto, flessibile nell’uso dei combustibili di partenza, di impatto ambientale assai ridotto (figura 3) con emissioni trascurabili e bassa rumorosità.
Comunque, nonostante i notevoli progressi compiuti a livello mondiale per affinare la tecnologia e le caratteristiche delle celle (v. riquadro), c’è da fare ancora molto lavoro per migliorare le prestazioni dei materiali; per incrementare le prestazioni energetiche e ambientali; per aumentare l’affidabilità e la durata; per semplificare i sistemi e ridurre i costi; per creare una rete di DISTRIBUZIONE del combustibile; e infine per consentire l’emissione di standard e normative.
LA QUESTIONE SICUREZZA
Esistono ancora molte perplessità per agli aspetti di sicurezza a causa della poca familiarità con questo vettore, il che porta ad applicare condizioni particolarmente restrittive per la sua utilizzazione.
Tuttavia, al di là della soggettiva “percezione di rischio”, un’analisi attenta ridimensiona il concetto di pericolosità dell’idrogeno.
Questo gas è meno infiammabile della benzina. Infatti la sua temperatura di autoaccensione è di circa 550 °C, contro i 230-500 °C (a seconda dei tipi) della benzina.
L’idrogeno è il più leggero degli elementi (quindici volte meno dell’aria), e perciò si diluisce molto rapidamente in spazi aperti.
È praticamente impossibile farlo detonare, se non in spazi confinati.
Per individuare concentrazioni potenzialmente pericolose (> 4% in aria) si utilizzano sensori che possono facilmente comandare adeguati sistemi di sicurezza.
I veicoli prototipo della BMW, ad esempio, hanno vetri e tettuccio che, in caso di presenza del gas, si aprono automaticamente.
Quando brucia, l’idrogeno si consuma molto rapidamente, sempre con fiamme dirette verso l’alto e caratterizzate da una radiazione termica a lunghezza d’onda molto bassa, quindi facilmente
assorbibile dall’atmosfera.
Per contro materiali come la benzina, il gasolio, il GPL od il GAS NATURALE sono più pesanti dell’aria e, non disperdendosi, rimangono una fonte di pericolo per tempi molto più lunghi.
È stato calcolato, facendo uso di dati sperimentali, che l’incendio di un veicolo a benzina si protrae per 20-30 minuti, mentre per un veicolo ad IDROGENO non dura più di 1-2 minuti (figura 4).
La bassa radiazione termica, propria delle fiamme da idrogeno, fa sì che esistano poche possibilità (al di là dell’ESPOSIZIONE diretta alla fiamma) che materiali vicini possano essere a loro volta
incendiati, riducendo così, oltre alla durata dell’incendio, anche il pericolo di emissioni tossiche.
L’idrogeno, al contrario dei combustibili fossili, non è tossico, né corrosivo ed eventuali perdite dai serbatoi non causano problemi di INQUINAMENTO del terreno o di falde idriche sotterranee.
Tratto da ENEA " IDROGENO energia del futuro"